细胞穿透肽(cell-penetrating peptides,CPPs)的转运机制以及应用
Published: 2020-12-23
Keyword:
CPPs 的转导机制
CPPs 具有物质转运载体的功能已被公认,但其内化的过程一直存在着争议。直接易位和内吞这两个解释为大家所普遍接受。因机体所处的环境变化,这两种内化途径可以相互转化。
细胞穿透肽(cell-penetrating peptides,CPPs)具有运载外源性物质进入cell且低毒、对导入物类型无特别的限制等特点。
1.
CPP 通过脂双层直接转运
CPPs 介导递送的zuì初步骤是基于带正电荷的氨基酸和cell表面带负电荷的膜磷脂双层形成静电相互作用将转导肽和外源性物质积聚在磷脂双层的外部小叶上,CPPs 变换结构使其疏水性氨基酸与cell膜的疏水性Core相互作用,使脂质双分子层稀疏,引起两者结合部位膜的短暂或者长时间的稳定失衡,CPPs 内流入cell内发生。
例如,Tat、MPG、Pep-1 以及部分抗微生物肽(AMPs)。高浓度 CPPs 可以使cell膜产生瞬间的孔隙,利于发生穿膜效应,这也可以解释一些高浓度 CPPs 致使cell死亡的现象。在转运中精氨酸(Arg)和赖氨酸(Lys)是中性 pH 下 CPPs 正电荷的主要贡献者,两者已经显示出高效促进cell附着,并且在一定范围内与每个肽的电荷数量与静电作用和穿透相互关联。
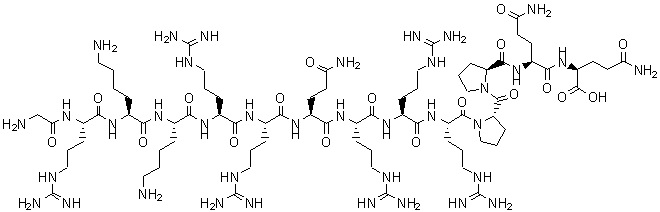
Tat(48-60)结构式/昂拓莱司绘制
尽管 Arg 和 Lys 残基都带正电,能促进cell结合,但与 Lys 相比,Arg 侧链具有能够建立二齿氢键的能力,这利于质膜蛋白、膜脂质和糖上的二齿阴离子磷酸,硫酸盐和羧酸基团建立相互作用。但Arg 的 R 基甲基化反应限制形成二齿键明显降低穿透能力。
2.
内吞介导的途径
在标准组织培养条件和中等肽浓度下,通常试验 中由 CPPs 介导的递送的内吞作用是广泛存在的机制。
简单地说,内吞途径的quán bù特性就是cell质膜与cell内膜结合的cell器的结合,然后将分子运输到cell内的特定位置。这是一个紧密协调,能源依赖过程,需要广泛的cell适配器和cell骨架重排。
随着cell器形成,内吞小泡在其从早期内体转变为晚期内体或多泡体时经历 pH 依赖性成熟过程。酸化过程依赖于离子梯度,需要钙、钠和钾的流出以及氢和氯的流入。
早期内体到晚期内体过程中配体(CPPs 与运载物的复合物)-受体(膜蛋白)复合物形成过程中可能有四种过程:受体离开内体返回质膜继续Cycle,配体被输送到溶酶体进行降解;受体、配体再Cycle;受体、配体再降解;配体受体穿胞转运。
CPPs已经显示出利用suǒ yǒu主要的内在途径:巨胞饮、网格蛋白(由分子量 180 kD 的重链和分子量 35~40 kD 轻链组成二聚体)依赖途径、小窝蛋白(分子量 21~24 kD) 依赖性内吞作用等途径 (图 1)
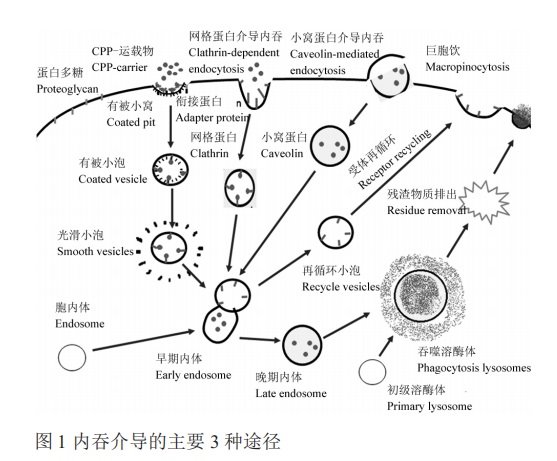
2.1
巨胞饮介导的内吞
巨胞饮是一种通过作用胞膜jí易形成皱褶而形成许多不规则的原始小泡将溶质或营养物质带入cell的非特异性的摄取大分子的途径,在作用的过程中,不依赖于受体和不依赖于膜蛋白的过程。
2.2
网格蛋白依赖性内吞
网格蛋白依赖性内吞作用被认为在suǒ yǒu cell类型中存在,并且以各种方式被利用,例如转铁蛋白、表皮shēng zhǎng因子受体、hormone和神经递质(再摄取期间)都由此途径所吸收。
2.3
小窝蛋白依赖性内吞
小窝蛋白介导的内吞作用是网格蛋白非依赖性内吞的常见形式。小窝蛋白是其主要的表面标志蛋白,主要存在于膜上囊泡、高尔基体和部分可溶性的脂蛋白复合物中,是一种膜整合蛋白,发挥着信号分子平台的作用。小窝蛋白介导的内吞与网格蛋白介导的内吞具有相似性,也是通过与质膜紧密结合的衔接蛋白,在募集到质膜后,小窝蛋白形成独特的“U”形,其N- 端和 C- 末端指向cell质,许多shēng zhǎng因子利用这个途径。
CPPs的应用
1.
肿瘤的治疗
CPPs能利用自身的穿膜效应携带化疗药物或生物试剂进入机体,细胞质或者靶向作用位点释放出运载物,以发挥最大的药效去治疗产生的肿瘤细胞。
Dubikovskaya等将穿透肽R8通过生物可裂解的二硫化物连接体与应用广泛的化疗药物紫杉醇(PTX)进行连接,穿透细胞膜后遇到高浓度谷胱甘肽作用于偶合物的化学键致使其裂解。
研究表明,无论是使用体外细胞培养还是进行动物模型,CPP-紫杉醇复合物用药的效果均高于单独使用紫杉醇。在紫杉醇耐药的细胞中,也能观察到药物活性的发挥。
2.
寡核苷酸和siRNA转运
寡核苷酸和siRNA是调节蛋白活化和转录后基因表达的重要工具,为特异性基因的靶向性治疗的重要手段,siRNA能够通过转录后的基因沉默发挥其基因治疗的作用。
在基因表达的研究、信号传递系统的研究、上下游分子相互作用等科研中被广泛地应用。其临床应用的主要障碍是被细胞摄取的能力较低,因此,科研者不断尝试新的方法改变其进入细胞的能力。
Li等构建细胞穿透肽油酰-八聚精氨酸(OA-R8)转铁蛋白(Tf)修饰的多功能脂质纳米颗粒(LNP)的新型siRNA递送系统sTOLP(装载siRNAOA-R8/Tf-修饰的LNP)。包封在sTOLP中的siRNA显示出有力的肿瘤抑制(61.7%),并且优先被含HepG2的小鼠中肝细胞和肿瘤细胞吸收,而不诱导免疫原性或肝或肾毒性,这无疑为肿瘤特异性治疗带来曙光。
3.
炎症靶向治疗
核转录因子kappaB(NF-κB)是细胞中重要的转录调节因子,通常以p50~p65二聚体的形式与其抑制性蛋白结合处于非活化状态。许多炎症反应的发生与NF-κB的激活有很大的关联。
许多炎症反应的发生与NF-κB的激活有很大的关联。据报道,NF-κB的持续性活化可能使机体产生一些慢性的炎症,例如类风湿性关节炎、帕金森氏病、炎症性肠病等。但是NF-κB的激活需要与NF-κB必需调节剂和激酶复合物相互作用。
Davé等通过将CPP(8K,八聚赖氨酸)与NF-κB必要调节器结合域(NBD)相结合,对炎症性肠病的小鼠模型进行腹腔注射性治疗,试验表明治疗组小鼠NF-κB的活化被抑制,炎症细胞因子TNF-α、IL-6、IL-1呈现下降的趋势,肠道炎症得到改善。
4.
杀菌作用
广谱的抗生素很难抑制或杀死胞内滋生的细菌,细菌的繁殖对动物和人类的机体健康造成很大的危害,特别是人畜共患的传染病。因细胞膜的选择透过性,药物难以穿透屏障造成药效无法达到理想状态。
有研究者尝试将CPP连接肽核酸(peptidenucleicacids,PNAs)可有效杀灭胞内李斯特氏菌及秀丽隐杆线虫(Milletti,2012),在一定程度上为CPP导入胞内杀菌药物的设计提供了思路。
Patel等将CPP((KFF)3K)与靶向基因acpP的起始密码子区域的PNA的10个核苷酸寡聚体相连接,发现其对淀粉霉有特异性的抑制作用。
将具有穿透作用的CPPs连接特异性的杀菌活性物质,通过直接转运或内吞的作用方式进入细胞内,具有特异性杀菌的活性物质在细胞内发挥选择性治疗作用,将为治疗胞内菌的提供更加可行的方案。
CPPs的展望
基于CPPs运送外源性物质进入到细胞膜中的功能是显而易见的,然而对于细胞的穿透性机制的了解是有限的。前人的研究已经得出几种常见的跨膜过程,但具体的跨膜尚未完全清楚以及何种机制的参与还有待探索。
此外,CPPs与外源性物质连接时,外源性物质对其穿膜机制的影响以及进入胞体内的位点和靶向性及其与溶酶体等有关代谢和降解的问题,还需要进一步的研究与完善。
CPPs潜在的高效性和特异性将会不断的被挖掘出来,随着多学科交叉应用的深入研究,CPPs将会在动物和人类的疾病治疗中发挥越来越重要的作用。



 关注我们
关注我们

