肿瘤靶向肽TR 多肽的应用进展
Published: 2016-10-19
Keyword:
客户文献:Yang Wang,Autophagy, 126, 949-962
背景:羟基氯喹(Hydroxychloroquine,HCQ)能抑制细胞自噬,因此可以增强一些癌细胞对化疗的敏感性,但是需要高剂量用药严重限制了其临床应用。
本文核心发现和研究意义:将HCQ加载到Lip-TR脂质体中可促进HCQ在B16F10肿瘤细胞和溶酶体中富集,从而降低用药剂量,减少毒性。HCQ /Lip-TR是一种先进的给药形式,应用潜力巨大,可开发成为强效的细胞自噬抑制剂。另外,Lip-TR作为药物载体,对其他细胞自噬调节剂也适用。

图1HCQ/Lip-TR将HCQ输送进入肿瘤细胞发挥自噬抑制的示意图:
(1)HCQ/Lip-TR分别通过EPR效应被动地,以及通过结合ITGAV-ITGB3/integrin avb3受体主动地靶向肿瘤细胞。
(2)在酸性的肿瘤微环境中,阴离子HCQ/Lip-TR转变成阳离子,促进HCQ/Lip-TR内吞。
(3)HCQ/Lip-TR被送入细胞中(I); HCQ被释放(II);游离的HCQ进入溶酶体并激活溶酶体中的相关蛋白酶(III);内吞溶酶体与自噬体融合形成自噬溶酶体(IV),但由于溶酶体中的酶被抑制,自噬作用被阻断(V)。
具体结果:
1.将HCQ装载入脂质体(HCQ /Lip),再用pH敏感的TH-RGD靶向肽修饰(HCQ /Lip)可使HCQ在B16F10黑素瘤细胞和溶酶体中富集(体内外研究结果)。
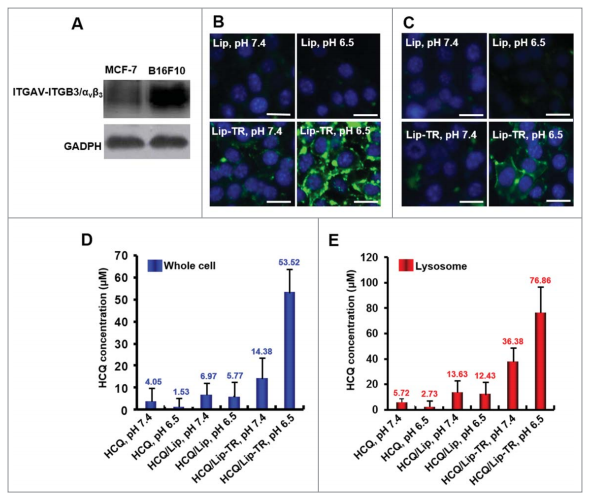
图5细胞摄取脂质体。(A)ITGAV-ITGB3/integrin avb3受体在B16F10和MCF-7肿瘤细胞中的表达情况。(B-C)CFPE标记的脂质体被(B)B16F10或(C)MCF-7细胞摄取情况。用100 mM HCQ, HCQ/Lip 或 HCQ/Lip-TR处理2h后,细胞内(D)和溶酶体内(E)HCQ的浓度。
体外研究结果显示,与用游离的HCQ相比,用HCQ/Lip-TR处理细胞后,细胞内HCQ的浓度提高35.68倍,溶酶体内HCQ的浓度提高32.22倍。

图6脂质体在体内靶向肿瘤细胞的能力。(A)C57BL/6 小鼠注射DiD-标记的脂质体24h后,体内(左)和离体(右)B16F10肿瘤图片。60 mg/kg HCQ, HCQ/Lip 或者 HCQ/Lip-TR注射24小时后,对肿瘤细胞(B)和溶酶体(C)内HCQ定量结果。
在荷瘤(B16F10)小鼠体内,肿瘤细胞中HCQ浓度升高15.16倍,在溶酶体中的浓度升高14.10倍。
2.与游离HCQ和HCQ/Lip 相比,HCQ/Lip-TR能更有效抑制肿瘤生长和延长荷瘤小鼠生存期。

图7HCQ/Lip-TR抗肿瘤效果。荷瘤(B16F10)小鼠分别用60 mg/kg HCQ、HCQ/Lip 或 HCQ/Lip-TR治疗,每两天给药一次,治疗32天。(A)动物体重和(B)肿瘤生长速度,(C)Kaplan–Meier生存曲线,(D)肿瘤提取物中LC3 和 SQSTM1/p62的WB结果,(E)治疗后电子显微镜照片,箭头指示自噬囊泡。
3.HCQ/Lip-TR 在体外和体内都能增强DOX对肿瘤的治疗效果。

在HCQ/Lip-TR存在下,DOX 或DOX/Lip杀伤肿瘤细胞的IC50值显著降低。该结果提示HCQ/Lip-TR与DOX 或DOX/Lip 联用可能增强DOX的抗肿瘤疗效。

图8DOX与HCQ联用的抗肿瘤效果。荷瘤(B16F10)小鼠用60 mg/kg HCQ和2 mg/kg DOX治疗。(A)动物体重和(B)肿瘤生长变化,(c)Kaplan–Meier生存曲线,(D)H&E 和TUNEL染色图片。
与PBS组相比,所有治疗组肿瘤生长受抑制,其中DOX/Lip +HCQ/Lip-TR抑制效果最强(图8B)。该治疗还让动物中位生存期达到> 60 d,另外根据H&E和 TUNEL染色,DOX/Lip +HCQ/Lip-TR还引起更多的细胞凋亡和坏死。
4.跟游离HCQ相比,HCQ/Lip-TR在体内毒性降低。

图9骨髓抑制评价。荷瘤小鼠分别用PBS, HCQ, HCQ/Lip 或 HCQ/Lip-TR治疗,在不同时间,检测(A)白细胞和(B)血小板的数目。
游离HCQ导致白细胞(WBC)和血小板(PLT)数目持续减少。在脂质体存在下,该作用被抑制,表明被脂质体包裹可以保护机体免受HCQ诱导的骨髓抑制。

被脂质体包裹的 HCQ在小肠中的聚集显著降低,但是在肿瘤中的聚集显著增多。HCQ/Lip-TR温和的贫血作用和轻度骨髓抑制,以及在小肠中聚集减少,提示其具有更低的肠道相关副作用。
5. 作用机制:HCQ/Lip-TR 阻断肿瘤细胞中的autophagic flux.

图5脂质体的自噬抑制作用。表达EGFP-LC3的B16F10 cells分布用100 mM HCQ, HCQ/Lip 或 HCQ/Lip-TR处理。(A)自噬体的激光共聚焦图片。(B)EGFP荧光定量。(C)LC3 和 SQSTM1/p62的WB。(D)LC3-II / LC3-I表达比例。(E)SQSTM1/p62相对于PBS组的表达水平。
肿瘤细胞分别用HCQ, HCQ/Lip 或 HCQ/Lip-TR处理后,所有细胞均出现荧光点,表明HCQ诱导产生自噬体。在pH 7.4 和 6.5下,HCQ/Lip-TR组的荧光比HCQ 或HCQ/Lip更明显,而在酸性条件下,仅HCQ/Lip-TR组的荧光显著升高(图 5A-B)。
LC3和 SQSTM1/p62在自噬过程中发挥关键作用,LC3-II / LC3-I比例升高提示发生自噬抑制。在pH 6.5,用100 mM HCQ剂量处理2h,HCQ/Lip-TR比HCQ或HCQ/Lip具有更高的LC3-II / LC3-I比例(图 5C-D)。在该ph下,HCQ/Lip-TR 处理组的SQSTM1/p62表达水平高于其它组,这进一步证实HCQ/Lip-TR诱导更强的自噬抑制作用(图 5C 和E)。
本文中使用的Ph敏感的肿瘤靶向肽TR 多肽
(c[RGDfK]-AGYLLGHINLHHLAHL[Aib]HHIL-Cys) 由浙江鸿拓生物技术股份有限公司合成。作为世界领先的生物技术公司,鸿拓生物致力于为全球客户提供专业和全面的蛋白质组学和基因组学解决方案。鸿拓常年提供抗体、多肽以及氨基酸等多种创新型生物制剂的解决方案,将满足广大客户多领域的科研需求。鸿拓还提供高尖端的定制服务,包括抗体生产、多肽合成以及可根据客户需求定制研究整体课题服务。
- Prev:点击化学(Click chemistry)在多肽合成中的应用
- Next:9月优惠大促销



 关注我们
关注我们

